Cargando historial...
Estado de oxidación en compuestos
El [estado de oxidación es un número que representa la carga eléctrica que tendría un átomo si los electrones compartidos en los enlaces se asignaran al elemento más electronegativo. Es fundamental para entender la formación de compuestos y su nomenclatura.
Aunque en la realizad no se da una transferencia completa de electrones, se considera que los elementos se intercambian electrones quedando unos con carga positiva.
El estado de oxidación se representa con un número entero que puede ser positivo, negativo o cero. Por ejemplo, en el cloruro de sodio (NaCl), el sodio tiene un estado de oxidación +1 y el cloro -1. El elemento mas electronegativo queda cargado negativamente y el menos electronegativo positivamente.
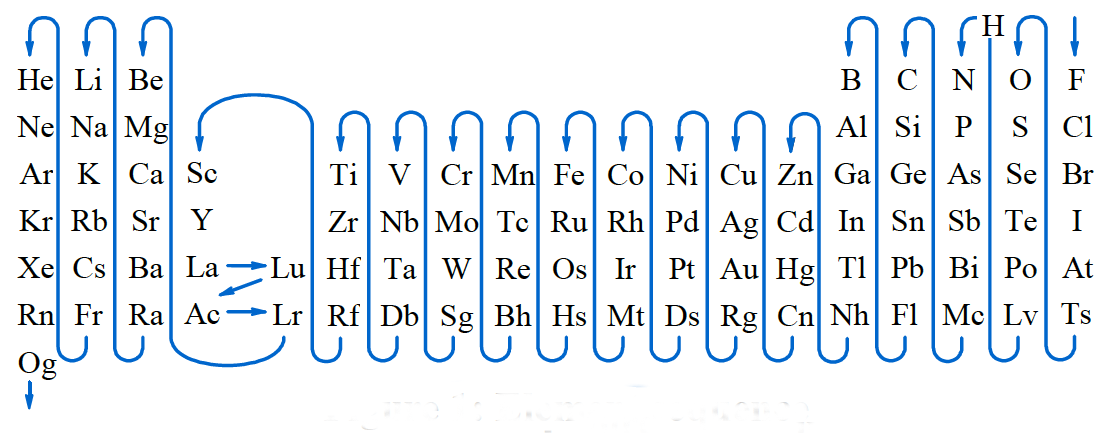
Que un elemento pierda o gane electrones depende de su electronegatividad y de su posición en la tabla periódica. Para ello el flúor es el elemento más electronegativo, y la electronegatividad disminuye al bajar en la tabla periódica e ir hacia la izquierda. El hidrógeno se situa antes del nitrógeno.
Fórmulas químicas
La fórmula química de un compuesto inorgánico se puede escribir de varias maneras.
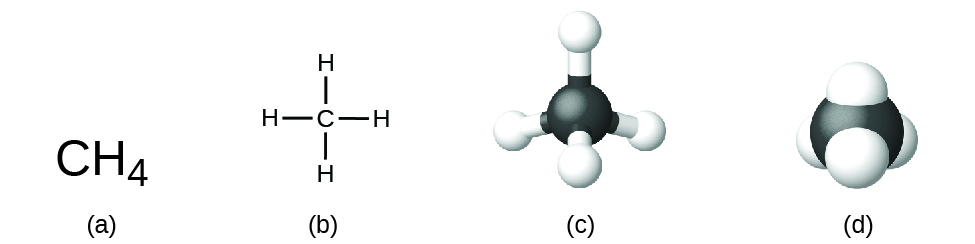
Fórmula molecular: tambien llamada condensada. Consiste en poner los elementos de un compuesto por orden de electronegatividad, de menor a mayor, y añadir el número de cada elemento mediante subíndices. Por ejemplo, en el metano (CH₄), el carbono es menos electronegativo que el hidrógeno, por lo que se escribe primero.
Fórmula empírica: representa la relación más simple entre los elementos. Es lo primero se obtiene al analizar un compuesto por diferentes tecnicas tradicionales. espectrometría de masas. Por ejemplo el etano (C₂H₆) tiene de fórmula empírica CH₃ que sería un compuesto poco estable.
Fórmula estructural: muestra la disposición real de los átomos en la molécula y cómo están conectados mediante enlaces. Puede representarse de diversas formas, desde diagramas bidimensionales que muestran los enlaces hasta modelos tridimensionales que reflejan la geometría espacial de la molécula. A su vez, la fórmula estructural puede estar semidesarrollada y solo indicar parte de la estrura del compuesto.
Número de valencia
El número de valencia es el número de enlaces o de carga que tiene un elemento habitualmente. Asi pues segun su electronegatividad los metales tienden a perder electrones y adquirir carga positiva, mientras que los no metales tienden a ganar electrones y adquirir carga negativa. Los elementos químicos tienden a tener la configuración electrónica de los gases nobles, especialmente los elementos más cercanos a estos. Los elementos mas lejanos a los gases nobles adquieren otras configuraciones electrónicas ya que si no quedarían excesivamente cargados.
Carga más probable de un elemento
Cada elemento tiende a adoptar ciertos estados de oxidación según su posición en la tabla periódica:
| Grupo 1/Li | Grupo 2/Be | Grupo 13/B | Grupo 14 /C | Grupo 15/N | Grupo 16/O | Grupo 17/F | Grupo 18/He) |
|---|---|---|---|---|---|---|---|
| +1 | +2 | +3 | +4, -4 | -3 | -2 | -1 | Poco reacctivos |
Solo los metales al calinos ( primera columna), alcalinotérreos (segunda columna) y del aluminio a la plata realizando una W/escalera (Al, Ga, Zn, Cd, Ag) pueden llegar a omitirse por tener casi siempre el mismo estado de oxidación.
Por ello solo es necesario recordaar una pequeña cantidad de elementos que suelen tene siempre un solo estado de oxidacion y que en ocsiones se sobreentienda y no se indique tal y como se indica en esta tabla:

Creación de fórmulas neutras
Los compuestos químicos son neutros, lo que significa que la suma de las cargas de los estados de oxidación de todos los átomos es cero. Para crear la fórmula de un compuesto, se deben seguir estos pasos:
Determinar el estado de oxidación de cada elemento.
Poner la carga del elemento contraria al subindice de cada elemento.
Simplificar los subíndices
Al³⁺ + O²⁻ → Al₂O₃ (no se puede simplificar más). Carga Al: +3·2 = +6; O: -2·3 = -6.
S²⁺ + O²⁻ → S₂O₂ → SO. Carga S: +2·1 = +2; O: -2·1 = -2.
Nomenclatura inorgánica
La nomenclatura inorgánica se refiere a la forma de nombrar los compuestos que no consisten en cadenas de carbono, que dan lugar a la vida. El carboono al poder enlazarse de diferentes formas hace que historicamente se haya separado la quimica de la vida y los elementos que se creaban en el laboratorio. Hoy en dia ya somos capaces de estudiar en el laboratorio todos los compuestos pero esta diferenciacion se sigue manteniendo. A su vez se han desarrollado otras nomenclaturas como la de los polímeros.
La IUPAC (International Union of Pure and Applied Chemistry - Unión Internacional de Química Pura y Aplicada) es la organización que establece intenta establecer un método regular para nombrar compuestos de forma que tengan un nombre único y permita saber su estructura.Debido al desarrollo de la química su nomenclatura ha ido cambiando y adaptándose a nuevas descubrimientos y compuestos. En el libro azul de la IUPAC se encuentran las reglas para nombrar este tipo de compuestos que puedes consultar de forma resumida en la guia breve IUPAC