Cargando historial...
Estructura de la Materia
La estructura de la materia estudia la organización de los átomos, sus propiedades y cómo estas determinan el comportamiento químico de los elementos y compuestos. Comprende desde la estructura atómica hasta los diferentes tipos de enlace químico.
Video introductorio
Evolución de los Modelos Atómicos
Modelo de Dalton (1803)
- Los átomos son partículas indivisibles e indestructibles
- Todos los átomos de un elemento son idénticos
- Los compuestos se forman por combinación de átomos en proporciones definidas
Modelo de Thomson (1904)
- "Pudín de pasas": electrones embebidos en una masa positiva
- Primer modelo que incluye electrones
- Explicaba la neutralidad eléctrica de los átomos
Modelo de Rutherford (1911)
- Núcleo denso y positivo en el centro
- Electrones orbitando alrededor del núcleo
- La mayor parte del átomo es espacio vacío
- Problema: electrón acelerado debería radiar energía y colapsar
Ejemplo: Experimento de Rutherford con lámina de oro
Bombardeó una lámina delgada de oro (espesor ~1 μm) con partículas alfa (núcleos de helio) de una fuente radiactiva. Observó que la mayoría de partículas atravesaban la lámina sin desviarse. Un pequeño porcentaje se desviaba en ángulos grandes, incluso rebotaban hacia atrás. Esto llevó a la conclusión de que el átomo tiene un núcleo denso pequeño rodeado de espacio vacío con electrones.
Modelo de Bohr (1913)
Introdujo postulados cuánticos:
- Los electrones solo pueden existir en órbitas específicas (estados estacionarios)
- En estas órbitas no radian energía
- La radiación ocurre solo en transiciones entre órbitas
- El momento angular está cuantizado: \[L = n\hbar\]
- Energías permitidas para el hidrógeno: \[E_n = - \frac{13.6}{n^2} \text{ eV}\]
Modelo Mecánico-Cuántico (1926)
Visualización de orbitales
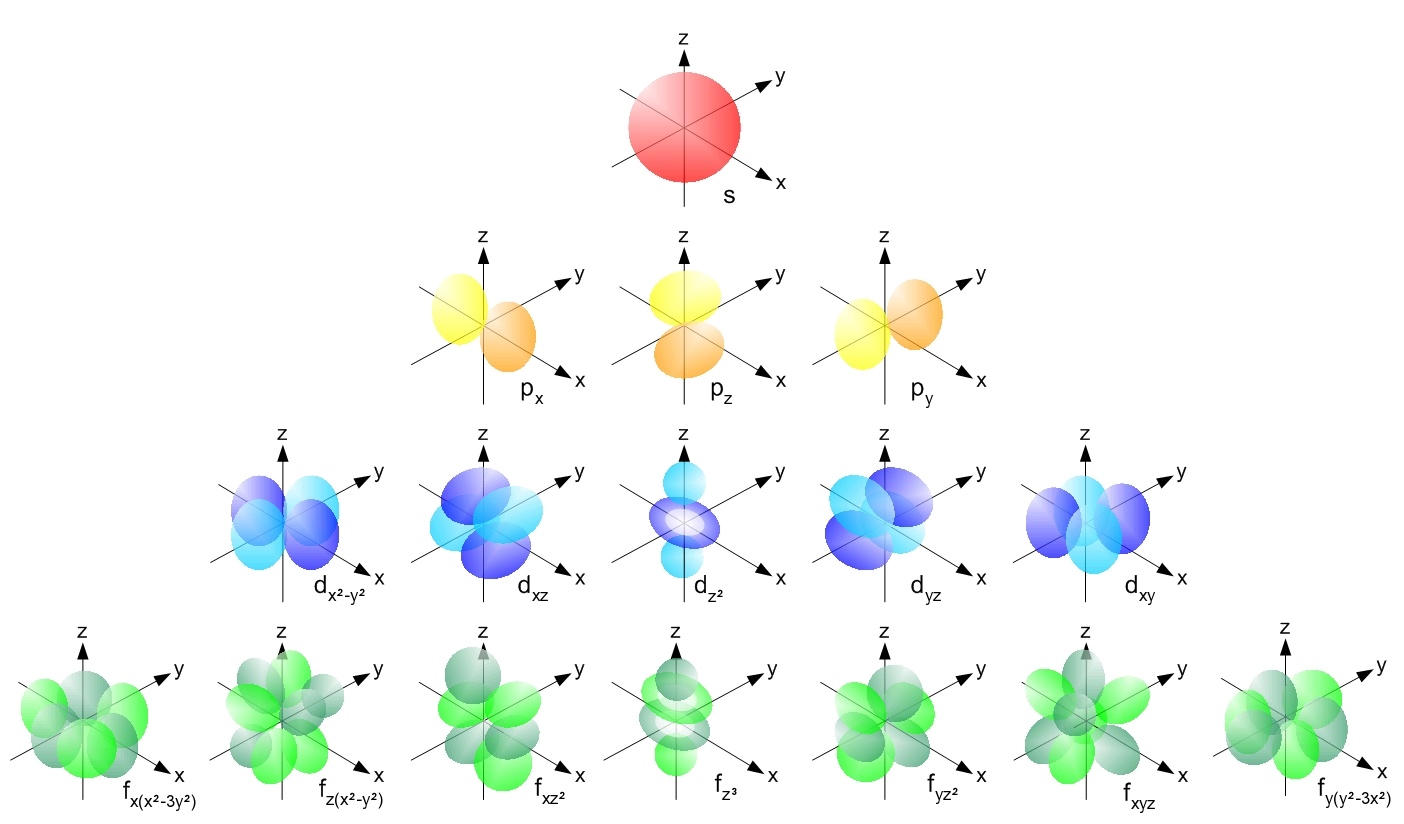
Basado en la ecuación de Schrödinger, describe la probabilidad de encontrar electrones en regiones del espacio llamadas orbitales.
Números Cuánticos
Cuatro números cuánticos describen completamente el estado de un electrón en un átomo:
1. Número cuántico principal (n)
- Valores: 1, 2, 3, 4, ...
- Indica el nivel de energía principal
- Determina el tamaño aproximado del orbital
- Máximo de electrones en un nivel:2n²
2. Número cuántico azimutal (l)$
- Valores: 0, 1, 2, ..., (n-1)
- Determina la forma del orbital
- l = 0: orbital s (esférico)
- l = 1: orbital p (bilobular)
- l = 2: orbital d (complejo)
- l = 3: orbital f (muy complejo)
3. Número cuántico magnético (ml)
- Valores: -l, -(l-1), ..., 0, ..., +(l-1), +l
- Determina la orientación espacial del orbital
- Para p: ml = -1, 0, +1 (3 orbitales)
- Para d: ml = -2, -1, 0, +1, +2 (5 orbitales)
4. Número cuántico de espín (ms)
- Valores: +1/2 o -1/2
- Describe el espín intrínseco del electrón
- Permite máximo 2 electrones por orbital
Configuración Electrónica
Principios de llenado
Principio de Aufbau
Los electrones llenan los orbitales desde menor a mayor energía:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p
Principio de exclusión de Pauli
No pueden existir dos electrones en un átomo con los cuatro números cuánticos iguales. Máximo 2 electrones por orbital con espines opuestos.
Regla de Hund
Los electrones ocupan orbitales de igual energía individualmente antes de aparearse, todos con el mismo espín.
Notaciones de configuración electrónica
Notación completa
Ejemplo: Configuración electrónica del Oxígeno (O, Z=8)
Notación abreviada
Fe (Z=26): [Ar] 4s² 3d⁶
Diagrama orbital
Muestra cada orbital con flechas indicando el espín de los electrones.
Propiedades Periódicas
Radio atómico
- Tendencia en un período: Disminuye de izquierda a derecha
- Tendencia en un grupo: Aumenta de arriba hacia abajo
- Causa: Carga nuclear efectiva y número de niveles electrónicos
Energía de ionización
Energía necesaria para quitar un electrón de un átomo gaseoso:
- Tendencia en un período: Aumenta de izquierda a derecha
- Tendencia en un grupo: Disminuye de arriba hacia abajo
- Ionizaciones sucesivas: EI₁ < EI₂ < EI₃ < ...
Afinidad electrónica
Energía liberada cuando un átomo gaseoso acepta un electrón:
- Generalmente aumenta hacia la derecha en un período
- Los halógenos tienen las afinidades electrónicas más altas
Electronegatividad
Capacidad de un átomo para atraer electrones en un enlace químico.
- Escala de Pauling: F = 4.0 (mayor electronegatividad)
- Tendencia en un período: Aumenta hacia la derecha
- Tendencia en un grupo: D
Ejemplo: Formación del NaCl
El sodio (Na) tiene configuración [Ne] 3s¹, con tendencia a perder 1 electrón para alcanzar la configuración noble. El cloro (Cl) tiene configuración [Ne] 3s² 3p⁵, con tendencia a ganar 1 electrón. Na pierde su electrón 3s para formar Na⁺, mientras que Cl gana ese electrón para formar Cl⁻. La atracción electrostática entre Na⁺ y Cl⁻ forma el enlace iónico.isminuye hacia abajo
Enlace Químico
El oxígeno (EN = 3.44) y el hidrógeno (EN = 2.20) tienen diferencia de electronegatividad de 1.24. Esto indica un enlace covalente polar, no es una transferencia completa de electrones. Los electrones se distribuyen desigualmente, el oxígeno atrae más densidad electrónica. Esto crea un dipolo permanente en la molécula de agua.Ejemplo: Formación del enlace O-H en el agua
Enlace iónico
Formado por transferencia de electrones entre un metal (baja electronegatividad) y un no metal (alta electronegatividad).
- Diferencia de electronegatividad: > 1.7
- Propiedades: Altos puntos de fusión, conducen electricidad en estado fundido
- Ejemplo: NaCl, MgO, CaF₂
Enlace covalente
Formado por compartición de electrones entre átomos de electronegatividades similares.
- Covalente puro: Diferencia de electronegatividad ≈ 0
- Covalente polar: Diferencia de electronegatividad 0.4 - 1.7
- Tipos: Simple, doble, triple
- Ejemplo: H₂, H₂O, CO₂, N₂
Enlace metálico
Formado por un "mar de electrones" deslocalizados entre cationes metálicos.
- Propiedades: Conductividad eléctrica y térmica, maleabilidad, ductilidad
- Modelo: Electrones de valencia deslocalizados
Teoría de enlace de valencia
Hibridación
Combinación de orbitales atómicos para formar orbitales híbridos equivalentes.
- sp³: 4 enlaces sigma, geometría tetraédrica (CH₄)
- sp²: 3 enlaces sigma, geometría trigonal plana (BF₃)
- sp: 2 enlaces sigma, geometría lineal (BeF₂)
Enlaces sigma (σ) y pi (π)
- Enlace σ: Solapamiento frontal de orbitales
- Enlace π: Solapamiento lateral de orbitales p
- Enlace simple: 1 σ
- Enlace doble: 1 σ + 1 π
- Enlace triple: 1 σ + 2 π
Geometría molecular (VSEPR)
La geometría molecular se determina por la repulsión de los pares de electrones de valencia (enlazantes y no enlazantes).
| Pares electrónicos | Geometría | Ejemplo | Ángulo |
|---|---|---|---|
| 2 | Lineal | CO₂ | 180° |
| 3 | Trigonal plana | BF₃ | 120° |
| 4 | Tetraédrica | CH₄ | 109.5° |
| 4 (2 pares libres) | Angular | H₂O | 104.5° |
Fuerzas Intermoleculares
Tipos de fuerzas intermoleculares
Fuerzas de van der Waals
- Fuerzas de London (dispersión): Presentes en todas las moléculas
- Interacciones dipolo-dipolo: Entre moléculas polares
- Fuerzas ion-dipolo: Entre iones y moléculas polares
Puentes de hidrógeno
Interacción especial cuando H está unido a N, O o F y se acerca a otro N, O o F.
- Más fuerte que las fuerzas de van der Waals
- Responsable de propiedades únicas del agua
- Importante en proteínas y ADN
Relación con propiedades físicas
- Punto de ebullición: Mayor fuerza intermolecular → mayor Tb
- Solubilidad: "Lo similar disuelve lo similar"
- Viscosidad: Relacionada con fuerzas intermoleculares
Ejemplos Resueltos
Ejemplo 1: Configuración electrónica
- Configuración del Fe neutro:
- Para formar Fe³⁺, se pierden 3 electrones:
- Configuración del Fe³⁺:
- Diagrama orbital del Fe³⁺:
Ejemplo 2: Geometría molecular
- Estructura de Lewis del NH₃:
- Geometría electrónica:
- Geometría molecular:
- Ángulo de enlace:
Ejemplo 3: Energía de red
¿Por qué los orbitales son así?
Aplicaciones Modernas
Nanotecnología
- Grafeno: propiedades excepcionales por estructura de hibridación sp²
- Nanotubos de carbono: aplicaciones en electrónica
- Puntos cuánticos: confinamiento cuántico
Ciencia de materiales
- Superconductores: estructura cristalina específica
- Semiconductores: bandas de energía y dopaje
- Polímeros: propiedades por estructura molecular
Química medicinal
- Diseño de fármacos basado en estructura molecular
- Interacciones proteína-ligando
- Química farmacéutica y biocompatibilidad